Myélome : quelle en est l'origine ?
L’origine de la maladie reste mal connue. Certains facteurs de risques sembleraient s’associer à des facteurs oncogéniques :
- l’âge (âge moyen de découverte : 66 ans),
- le sexe (prépondérance masculine),
- la race (noire),
- l’exposition aux radiations ou à certains facteurs environnementaux (pesticides), à des virus (EBV), l’obésité…
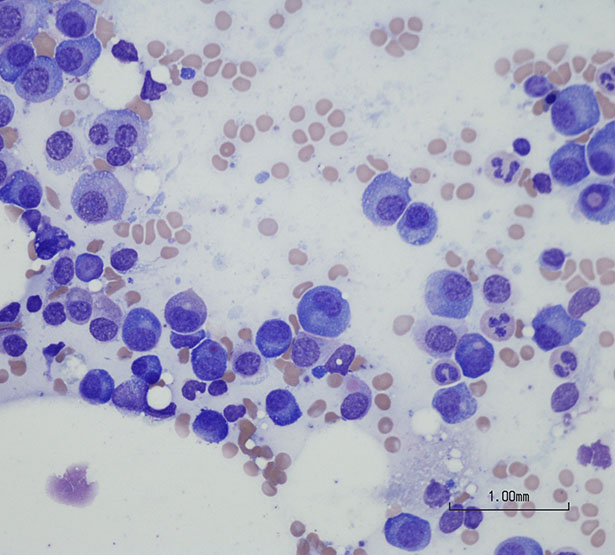
Sur le plan physiopathologique, la prolifération d’un clone de plasmocytes "malins" conduit à la production en excès d’un type d’immunoglobuline à l’origine d’un pic monoclonal composé des mêmes chaînes lourdes G ou A et des mêmes chaînes légères kappa ou lambda qui définiront le type du myélome.
L’envahissement de la moelle osseuse par les plasmocytes tumoraux diminue la production des autres lignées sanguines (à l’origine notamment d’une anémie, de la diminution des défenses immunitaires ou de saignements) et entraîne progressivement la destruction de l’os rendant compte des manifestations osseuses (douleurs, fractures spontanées) tandis que la sécrétion en excès de protéines dans le sang et l’urine peut conduire à une insuffisance rénale.
Mais les signes cliniques étant peu spécifiques, voire totalement absents au début, le diagnostic de myélome est souvent retardé. Ce qui peut avoir des conséquences dramatiques pour le malade, et parfois conduire à la mise en cause pour retard de diagnostic des praticiens consultés et s’étant fait piéger par cette symptomatologie "banale".
Un exemple de diagnostic tardif
en 2015, un sociétaire médecin généraliste renvoie très rapidement une de ses patientes de 69 ans, hypertendue connue, vers son cardiologue habituel, un bilan demandé de manière systématique venant de mettre en évidence :
- une anémie à 11 g (sans saignement extériorisé) ;
- une dégradation de la fonction rénale (créatinémie à 111 mmoles/l et clearance à 45 ml/mn).
La malade se plaint par ailleurs d’être fatiguée et d’avoir perdu du poids.
Le cardiologue procède donc à un bilan complet avec successivement un Holter du fait d’une tachycardie puis une échographie concluant à une cardiopathie hypertensive.
Une supplémentation en fer est mise en route en l’attente des résultats d’un bilan ferrique qui se révélera normal.
Un contrôle biologique est réalisé en septembre, montrant une anémie encore un peu plus profonde et une dégradation de la fonction rénale avec une clearance 38 ml/mn chez cette patiente dont l’état général ne cesse de se dégrader.
Ce n’est finalement qu’en février, soit 8 mois plus tard, qu’une électrophorèse des protéines est demandée, mettant en évidence un pic monoclonal à 1 g A.
L’expertise constate que dès le bilan de juin 2015, une vitesse de sédimentation a été demandée et s’est révélée élevée, à 90 mm à la 1re heure , la CRP étant elle normale, élément non pris en considération par le médecin généraliste.
Médecin généraliste qui a alors demandé un scanner abdominopelvien pour "exploration d’un syndrome inflammatoire biologique et insuffisance rénale", avec injection (!) , heureusement faite à demie dose en mai.
Aucun contrôle biologique n’a été demandé avant le mois de juillet, date à laquelle la clearance étant de 10 ml/mn. Le médecin généraliste a enfin adressé la patiente au centre hospitalier voisin où elle a été immédiatement dialysée, puis confiée à l’équipe d’hématologie pour le bilan et le traitement de son myélome.
Comme attendu, la responsabilité de notre sociétaire généraliste a été retenue :
- pour avoir tardé à demander une électrophorèse des protéines ;
- et surtout ne pas avoir confié sa patiente à un spécialiste en hématologie dès le résultat évocateur d’un myélome obtenu en février, au vu aussi du développement rapide d’une insuffisance rénale sévère dans le contexte d’une altération de l’état général.
Et comme attendu aussi, il sera condamné à indemniser la patiente de ses préjudices à hauteur de 180 000 euros et à prendre en charge la créance de la CPAM s’élevant à plus de 120 000 euros.
Si, dans ce cas, les fautes cumulées par notre sociétaire généraliste ne permettaient pas d’espérer un issue médico-légale différente, nous avons pu fort heureusement, dans d’autres dossiers, mettre en avant les difficultés diagnostiques habituelles que pose le myélome pour défendre certains sociétaires (notamment généralistes).
Un diagnostic et une prise en charge difficiles
Toute augmentation de la VS chez une personne âgée, a fortiori quand la CRP est normale, doit au minimum conduire à la vérification de l’électrophorèse des protides, et toute découverte d’un pic monoclonal impose, même en l’absence de signes cliniques, au minimum un certain nombre d’explorations, un contrôle rapproché, voire de confier le patient à un spécialiste pour avis.
En effet, dans 20 % des cas, le myélome est découvert de manière fortuite (augmentation de la VS, pic d’immunoglobuline supérieur ou égal à 30 g/L en l’absence de critères d‘atteinte d’organes) alors qu’il est encore asymptomatique : il est dit alors indolent.
La difficulté pour le praticien est de repérer ces anomalies et son rôle consiste à diriger son patient vers un spécialiste. En effet, compte tenu du risque d’évolution vers un myélome multiple (10 %/an les 5 premières années), une surveillance étroite s’impose.
Et la question, difficile à résoudre même pour l’hématologue et qui peut faire l’objet d’une décision en réunion de concertation multidisciplinaire, est de déterminer si, compte tenu de l’âge et de l’état général du patient, il est préférable de le surveiller ou de le traiter.
En effet, un dérivé de la thalidomide semblerait pouvoir ralentir la progression tumorale au prix cependant d’effets indésirables non négligeables. L’abstention thérapeutique sous couvert d’une surveillance armée reste cependant le plus souvent la règle à ce stade.
Myélome multiple : les signes d'alerte à retenir
Dans les autres cas où le myélome est symptomatique, il prend le nom de myélome multiple.
Les signes les plus fréquemment rencontrés sont une asthénie avec altération de l’état général, d’origine multifactorielle, à laquelle peuvent s’associer :
- vertiges et dyspnée suivant la profondeur de l’anémie (A) ;
- nausées, perte de poids, prurit en cas d’insuffisance rénale associée (R) ;
- vomissements, douleurs abdominales… en cas d’hypercalcémie (C) ;
- et des douleurs osseuses (B), en particulier au niveau du rachis, des tassements, source de sciatalgie ou de cruralgie.
Le caractère symptomatique du myélome repose donc sur la présence de ces signes et de la présence d’au moins un des 4 critères dits CRAB que tout médecin devrait avoir en tête :
- C (hyperCalcémie),
- R (insuffisance Rénale),
- A (Anémie),
- B (Bone, douleurs osseuses).
Les critères diagnostiques les plus reconnus dans la spécialité, mais plus complexes à mémoriser, sont désormais ceux de l’International Myeloma Working Group (IMWG).
Ces critères, qui auparavant permettaient l’identification des patients avec un myélome asymptomatique à très haut risque de progression vers un myélome multiple, ont été révisés en 2014 et ils servent désormais de critères diagnostique du myélome multiple2.
La suspicion de myélome impose la réalisation d’un bilan biologique complet comportant notamment :
- une électrophorèse des protides ;
- une évaluation de la fonction rénale avec dosage de protéinurie (et électrophorèse des protéines urinaires) ;
- un dosage de la beta2 microglobuline (facteur pronostique) ;
- un myélogramme et un bilan d’imagerie osseuse (radiographies crâne, rachis, gril costal, bassin..., IRM...).
Au terme du bilan, il devient possible de classer le myélome parmi 3 stades de sévérité croissante selon la classification de Durie et Salmon3 qui prend en compte :
- le taux d’hémoglobine ;
- la calcémie ;
- le taux de l’immunoglobuline monoclonale ;
- et l’atteinte osseuse avec une différenciation en "sous stade" A ou B suivant la normalité ou pas de la fonction rénale.
L’existence d’une masse tumorale importante, d’un dosage élevé de la beta2 microglobuline dans le sang, de certaines anomalies cytogénétiques ou d’une insuffisance rénale, constituent autant de facteurs témoignant de la gravité de la maladie comme des difficultés à venir pour la traiter :
- Au stade I (myélome dit indolent) : le traitement repose sur l’abstention thérapeutique sous couvert d’une surveillance armée.
- Aux stades II et III : l’autogreffe de cellules souches hématopoïétiques qui, en France est autorisée jusqu’à 65 ans, est devenue le traitement de référence du myélome chez les malades "jeunes" et "éligibles à la greffe" (sans autres pathologies associées). Elle est précédée d’une chimiothérapie première, dite d’induction, puis d’une chimiothérapie de consolidation et associée à d’autres thérapies ciblées et est nécessairement suivie d’un traitement d’entretien.
- Au-delà de 65 ans ou de non éligibilité à une telle greffe : d’autres traitements sont à discuter en fonction des cas.
En plus des chimiothérapies dites désormais "classiques" par melphalan ou cyclophosphamide, de nouveaux protocoles sont désormais proposés aux patients associant un immunomodulateur (lenalidomide, thalidomide...), un corticoïde (dexaméthasone) et un inhibiteur du protéasome comme le Velcade (bortezomib).
Mais ces protocoles sont amenés à évoluer encore rapidement, l’efficacité de l’ajout d’anticorps anti CD8 (ciblant donc une CD8, une protéine membranaire exprimée par les plasmocytes tumoraux notamment) étant désormais démontrée.
En effet, lors du dernier congrès mondial de la cancérologie (American Society of Clinical Oncology) (ASCO) ayant eu lieu en juin 2024, il a été fait état d’essais cliniques venant montrer une augmentation significative des rémissions et de la durée de celles-ci chez les patients non éligibles à la greffe et recevant en sus du traitement "classique", de l’isatuximab, un nouvel anticorps de type anti CD 38. Ce qui avait déjà été montré pour un autre AC du même type, le daratumumab mais cette fois chez les patients ayant reçu une autogreffe.
Une maladie grave imposant une prise en charge multidisciplinaire
Parallèlement, il sera nécessaire tout au long de la maladie qui évolue selon une alternance de poussées et de rémissions, de prévenir ou de devoir traiter les douleurs osseuses, souvent au premier plan, et certaines complications imposant une prise en charge pluridisciplinaire : fractures ou tassements vertébraux, accidents thromboemboliques, infections, insuffisance rénale... comme il sera aussi nécessaire de prévenir ou de traiter les effets indésirables de certains des traitements instaurés.
Le rôle du médecin généraliste est à ce niveau essentiel et suppose une parfaite connaissance de la maladie et de ses traitements.
—
Une bonne coopération avec le spécialiste et l’équipe hospitalière en charge du malade est également nécessaire.
Les récents progrès thérapeutiques ont permis une amélioration nette de la qualité de vie des patients.
Si le myélome reste encore une maladie incurable, le taux de survie à 5 ans dépasse 50 % au stade I et les 30 % au stade III, faisant désormais du myélome une maladie certes toujours grave mais "possiblement" chronique.